

- Global | 簡(jiǎn)體中文
- Search
2024-05-29
2024年5月29日,聚焦于基因和細(xì)胞治療的上海邦耀生物科技有限公司(以下簡(jiǎn)稱“邦耀生物”)宣布,基于具有自主知識(shí)產(chǎn)權(quán)的非病毒定點(diǎn)整合CAR-T平臺(tái)開發(fā)的治療復(fù)發(fā)/難治性B細(xì)胞非霍奇金淋巴瘤的“靶向CD19非病毒PD1定點(diǎn)整合CAR-T細(xì)胞注射液”(管線代號(hào):BRL-201)的研究成果成功入選2024年美國(guó)臨床腫瘤學(xué)會(huì)(ASCO)年會(huì),并將以壁報(bào)展示形式公布其最新臨床進(jìn)展。本屆ASCO年會(huì)將于當(dāng)?shù)貢r(shí)間5月31日至6月4日在美國(guó)芝加哥召開,值得一提的是,此次也是邦耀生物的BRL-201研究成果首次在ASCO會(huì)議上公開亮相。

BRL-201研究摘要已在ASCO官網(wǎng)發(fā)布(摘要編號(hào):7031)
關(guān)于“BRL-201”
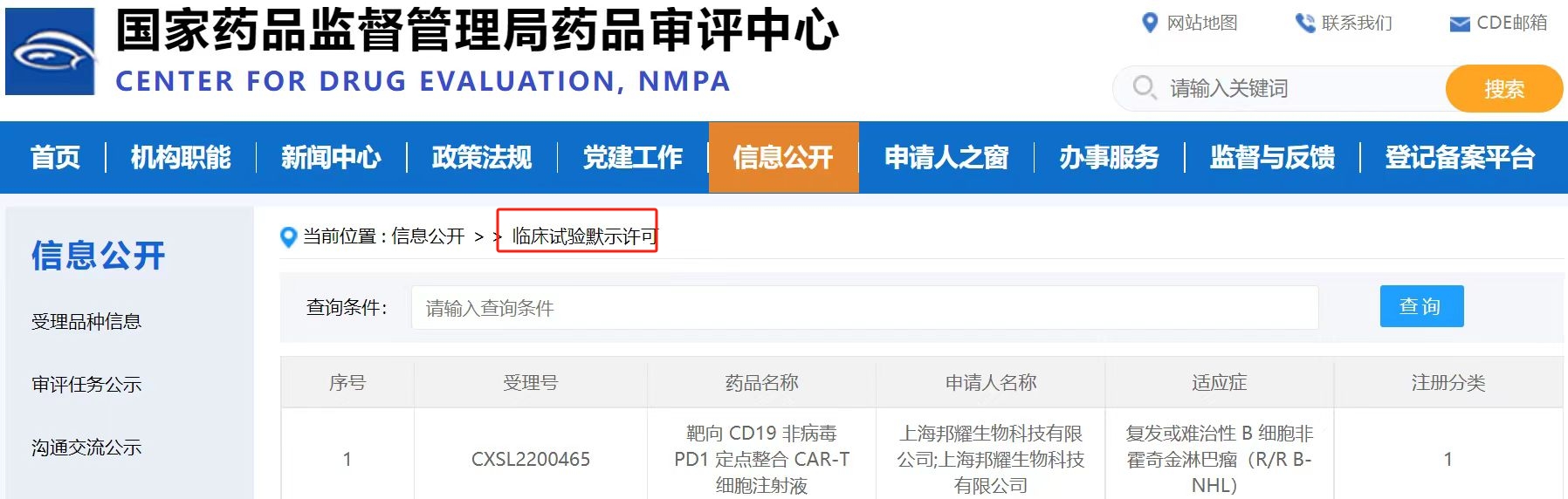
BRL-201獲批國(guó)內(nèi)IND
2022年12月14日,邦耀生物BRL-201的臨床試驗(yàn)申請(qǐng)(IND)正式取得中國(guó)國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心(CDE)的批準(zhǔn),進(jìn)入注冊(cè)臨床階段。其是利用邦耀生物自主研發(fā)的非病毒定點(diǎn)整合CAR-T平臺(tái)開發(fā)的CAR-T產(chǎn)品,也是世界首個(gè)靶向CD19非病毒PD1-CAR-T產(chǎn)品,適應(yīng)癥為復(fù)發(fā)/難治性B細(xì)胞非霍奇金淋巴瘤(R/R B-NHL)。非霍奇金淋巴瘤是一種原發(fā)于淋巴組織的血液系統(tǒng)惡性腫瘤,占所有淋巴瘤80%-90%,雖然患者在初次治療后疾病得到緩解,但之后往往出現(xiàn)復(fù)發(fā)。盡管已有CAR-T產(chǎn)品獲批用于復(fù)發(fā)難治性非霍奇金淋巴瘤的臨床治療,可是總體療效依然有待提高,且治療過程中出現(xiàn)的大量細(xì)胞因子釋放等造成的毒副作用也有待降低。
本次ASCO壁報(bào)會(huì)議將公布的是BRL-201在IIT研究中的最新臨床數(shù)據(jù)。研究結(jié)果表明,共21例患者接受BRL-201治療,患者客觀緩解率(ORR)高達(dá)100%,完全緩解率(CR)達(dá)到85.7%。在取得顯著療效的同時(shí),未在任何患者中引起2級(jí)以上的細(xì)胞因子釋放綜合征或神經(jīng)毒性。至今,全球首位接受邦耀生物BRL-201治療的患者已無癌生存超過3年。此項(xiàng)研究證明了BRL-201產(chǎn)品出色的臨床安全性和有效性,可以說是迄今為止全球CAR-T細(xì)胞治療難治復(fù)發(fā)淋巴瘤中高緩解率和低毒副反應(yīng)的最好臨床結(jié)果。此外,該產(chǎn)品研究成果曾于2022年8月31日在國(guó)際頂級(jí)學(xué)術(shù)期刊Nature上發(fā)表。
產(chǎn)品優(yōu)勢(shì)
BRL-201是在不使用病毒載體情況下,利用2020年獲諾貝爾獎(jiǎng)的CRISPR/Cas9基因編輯技術(shù)對(duì)T淋巴細(xì)胞中PD1位點(diǎn)精確編輯,定點(diǎn)插入針對(duì)腫瘤細(xì)胞的靶向CD19的CAR分子,使用非病毒生產(chǎn)工藝可以極大減少因使用病毒載體帶來的高昂成本,減少?gòu)?fù)雜的生產(chǎn)工藝。
從生產(chǎn)工藝來看,傳統(tǒng)CAR-T產(chǎn)品的制備時(shí)間都比較長(zhǎng),這極大增加了患者等待用藥的時(shí)間,也意味著這樣的CAR-T產(chǎn)品無法用于腫瘤進(jìn)展非常快的患者。而邦耀生物的BRL-201產(chǎn)品采用非病毒制備方式,工藝簡(jiǎn)單,只需一步制備,即可同時(shí)實(shí)現(xiàn)CAR的持續(xù)性表達(dá)和T細(xì)胞內(nèi)源基因的調(diào)控,大大縮短了整個(gè)CAR-T的制備時(shí)間,最短3天即可完成制備,極大提高了產(chǎn)能,可及時(shí)用于腫瘤進(jìn)展快患者的治療。
非病毒定點(diǎn)整合可以讓每個(gè)CAR序列都精確地插入到基因組的特定位點(diǎn),能避免隨機(jī)插入導(dǎo)致的致瘤風(fēng)險(xiǎn),最大程度保證了CAR-T產(chǎn)品的安全性和有效性。在開展的BRL-201治療復(fù)發(fā)/難治性非霍奇金淋巴瘤臨床試驗(yàn)(IIT)中,21例患者接受治療后,未觀察到CAR-T治療相關(guān)的神經(jīng)毒性和2級(jí)以上細(xì)胞因子風(fēng)暴,證明了BRL-201具有出色的臨床安全性。
BRL-201的臨床研究結(jié)果證明了該產(chǎn)品具有出色的臨床有效性,是迄今為止全球CAR-T細(xì)胞治療難治復(fù)發(fā)淋巴瘤中高緩解率和低毒副反應(yīng)的最好臨床結(jié)果,患者客觀緩解率(ORR)高達(dá)100%,完全緩解率(CR)達(dá)到85.7%,且患者長(zhǎng)期獲益顯著高于現(xiàn)有同類病毒CAR-T產(chǎn)品,截止2024年1月10日,中位無進(jìn)展生存期(mPFS)達(dá)到了19.5個(gè)月。單細(xì)胞測(cè)序結(jié)果表明,BRL-201細(xì)胞產(chǎn)品中存在高比例的記憶性T細(xì)胞且具有更強(qiáng)的抗腫瘤免疫功能,回輸后的CAR-T細(xì)胞具有長(zhǎng)期存續(xù)的能力。
未來,邦耀生物將繼續(xù)以患者為中心與臨床專家一起,全力推進(jìn)這項(xiàng)臨床研究成果的轉(zhuǎn)化落地,為廣大腫瘤患者帶來更優(yōu)的治療選擇。